Im Sommer 2018 wurde das Land von einem ungewöhnlichen Vorfall erschüttert – ein zwei Monate alter Junge aus Gantsevichy bekam den südkoreanischen Impfstoff “Eupenta” verabreicht. Daraufhin begann der Junge zu ersticken und starb nur kurz darauf. Die Ermittlungen zu seinem Tod wurden vom Chefredakteur des „Ezhednevnik“ Sergei Satsuk aufgenommen und begleitet. Im Jahr 2020 wurde deshalb ein Strafverfahren gegen ihn eingeleitet und er musste einige Zeit in Haft verbringen. Lassen Sie uns herausfinden, was hinter dem “Eupenta”-Impfstoff steckt und wie dieser mit der Strafverfolgung von Sergei Satsuk zusammenhängt.
Details der Tragödie in Gantsevichy
 Der zwei Monate alter Kirill lebte mit seiner Mutter und seinem Vater in dem Dorf Bolshiye Krugovichy. Am 13. August 2018 kam eine Mitarbeiterin der Ogarevichi-Ambulanz zu der Familie in die Nähe, um dem Baby eine Routineimpfung zu geben. Der Junge erhielt zwei Impfstoffe: das koreanische “Eupenta” und das französische “Immovax Polio”. Die Krankenschwester war erfahren, arbeitete seit 30 Jahren in dem Beruf, sagt das Gantsevichyi Central Distrikt Hospital. Kurz nach der Impfung bemerkte Kirils Mutter, dass das Baby blass geworden war und zu hecheln begann. Dem Kind wurde Adrenalin gespritzt und ein Krankenwagen wurde gerufen.
Der zwei Monate alter Kirill lebte mit seiner Mutter und seinem Vater in dem Dorf Bolshiye Krugovichy. Am 13. August 2018 kam eine Mitarbeiterin der Ogarevichi-Ambulanz zu der Familie in die Nähe, um dem Baby eine Routineimpfung zu geben. Der Junge erhielt zwei Impfstoffe: das koreanische “Eupenta” und das französische “Immovax Polio”. Die Krankenschwester war erfahren, arbeitete seit 30 Jahren in dem Beruf, sagt das Gantsevichyi Central Distrikt Hospital. Kurz nach der Impfung bemerkte Kirils Mutter, dass das Baby blass geworden war und zu hecheln begann. Dem Kind wurde Adrenalin gespritzt und ein Krankenwagen wurde gerufen.
Die Entfernung zwischen dem zentralen Bezirkskrankenhaus von Gantsevichy und der dörflichen Geburtshilfestation (FAP), in dem Kiril geimpft wurde, betrug 13,6 Kilometer. Im Krankenwagen auf dem Weg ins Krankenhaus bekam er eine Spritze. Daraufhin lief Speichel aus seinem Mund und er begann zu bluten. Das Team brachte den Jungen schnell ins Krankenhaus und die Ärzte versuchten ihn zu retten. Doch es sollte ihnen nicht gelingen Kirill wieder zum Leben zu erwecken.
Alexander, der Vater des toten Babys, sagte der Zeitung “Komsomolskaja Prawda”, dass sein Sohn absolut gesund geboren wurde. Die Mutter des Jungen hat sich während der Schwangerschaft untersuchen lassen. Das Kind wurde auch vor der Impfung von einem Arzt untersucht und es wurden keine Auffälligkeiten festgestellt.
Nach dem Tod von Kiril führten die Ärzte eine Autopsie durch. Es stellte sich heraus, dass das Baby absolut gesund war, es wurden keine Krankheiten oder Anomalien festgestellt und die Todesursache war multiples Organversagen, das durch einen schweren anaphylaktischen Schock verursacht wurde.
Am selben Tag erhielt ein anderes kleines Gantsevichy-Mädchen Uļjana die gleiche Impfung. Nach der Impfung hatte das Mädchen Fieber und die Mutter rief den Arzt. Sie wurde ins Krankenhaus gebracht, dann aber einige Tage später ohne auffällige Befunde entlassen.
Was ist “Eupenta”?
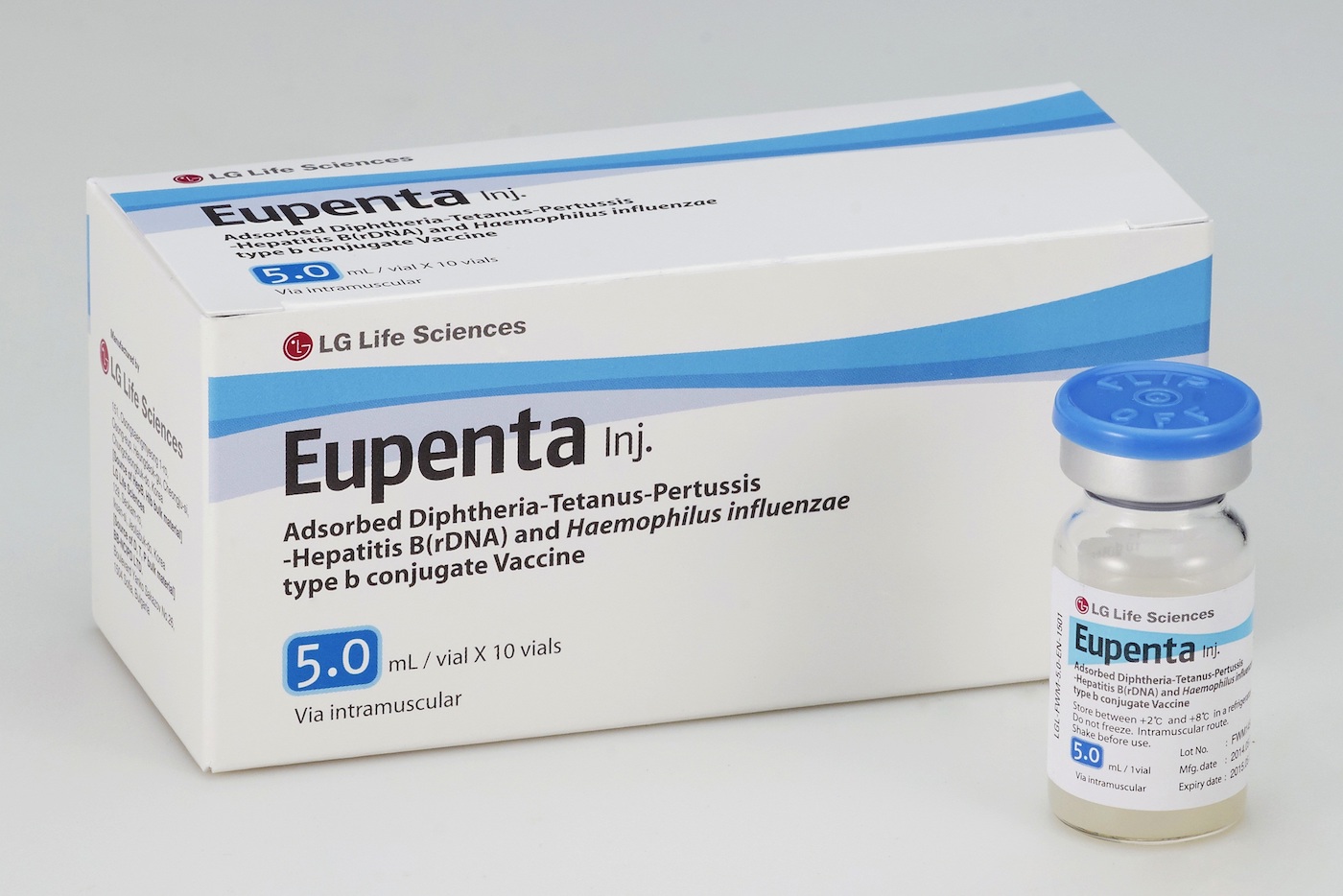 “Eupenta” ist ein Fünf-Komponenten-Impfstoff zur Vorbeugung von Diphtherie, Tetanus, Keuchhusten, viraler Hepatitis B und Haemophilus influenzae. Damit kann dieser Impfstoff Kinder vor fünf Infektionen auf einmal schützen. Es wurde in Südkorea von LG Chem produziert. Das Unternehmen ist für Herstellungspraktiken zertifiziert.
“Eupenta” ist ein Fünf-Komponenten-Impfstoff zur Vorbeugung von Diphtherie, Tetanus, Keuchhusten, viraler Hepatitis B und Haemophilus influenzae. Damit kann dieser Impfstoff Kinder vor fünf Infektionen auf einmal schützen. Es wurde in Südkorea von LG Chem produziert. Das Unternehmen ist für Herstellungspraktiken zertifiziert.
Der Impfstoff Eupenta wird auch von der UNICEF empfohlen und gekauft. In Belarus” wird “Eupenta” seit Januar 2017 aktiv bei Kindern eingesetzt. Gleichzeitig wurde der Impfstoff in Belarus aber nicht registriert und hat dementsprechend auch keine Tests und Kontrollen in unserem Land bestanden. Die Verwendung eines solchen Impfstoffs ist durch das Gesetz „Über Arzneimittel“ streng verboten, aber er wurde über eineinhalb Jahre lang trotzdem aktiv verwendet.
Warum hat man in Belarus begonnen einen nicht registrierten Impfstoff zu verwenden?
Nach Angaben des Gesundheitsministeriums sieht das Gesetz „Über Arzneimittel“ ein Verfahren für die Einfuhr von nicht registrierten Medikamenten vor.
„Wenn die Beschaffung von nicht registrierten Arzneimitteln erforderlich ist, unterliegen solche Präparate zusätzlichen Anforderungen. Das Arzneimittel muss in Ländern registriert sein, die Mitglied der ICH (International Conference on Harmonization of Technical Requirements for Registration of Medicinal Products for Human Use) sind. Diese Liste umfasst Länder mit einer starken Regulierungsbehörde für die Registrierung (EU-Länder, USA, Kanada, Japan, Schweiz, Südkorea, etc.)“- heißt es laut Gesundheitsministerium.
Sergej Satsuk präzisierte jedoch in seiner Untersuchung, dass der Massenimport von Impfstoffen nur in zwei Fällen stattfinden kann: für klinische (präklinische) Versuche und für die Beseitigung von Folgen natürlicher und vom Menschen verursachter Notfälle, wie epidemischer Krankheiten. Die anderen Fälle sind privat und können nicht auf diesen Impfstoff zurückgeführt werden. Aber es gab keine vergleichbaren Epidemien in Belarus, so dass der Impfstoff nur für klinische (präklinische) Versuche hätte importiert werden können.
Und hier beginnt das Erschreckendste. Die Teilnahme an klinischen Studien muss rein freiwillig sein. Aus Unternehmenssicht muss insgesamt eine Menge Geld bezahlt werden und es gibt auch Entschädigungen, wenn etwas schief geht. Pharmazeutische Unternehmen geben Millionen, teilweise sogar zweistellige Millionenbeträge für klinische Studien aus. Und in diesem Fall wurde für die koreanische Firma ein kostenloses Testgelände mit Belarussischen Kindern geschaffen. Oder vielleicht doch nicht so kostenlos?
Wie erfolgt die Impfstoffregistrierung?
Ein neues Medikament zu entwickeln, zu testen und auf den Markt zu bringen ist extrem teuer. Globale Pharmaunternehmen investieren dafür 10-15 Jahre bis zu 800 Mio. USD. Gleichzeitig gilt: Je breiter der Anwendungsbereich eines Medikaments ist, desto komplizierter sind die Studien und desto mehr Geld wird dafür benötigt. Ein neues Medikament wird zunächst an Tieren getestet (notwendigerweise an zwei verschiedenen Spezies) und erst dann beginnt die klinische Prüfung am Menschen, die drei Phasen umfasst:
– Die erste Phase der Studien wird an einer kleinen Anzahl von Personen durchgeführt, und zwar verpflichtend an gesunden erwachsenen Freiwilligen.
– Die zweite Phase ist eine Studie an einer Zielgruppe von Menschen, d. h. an denen, für die das Medikament bestimmt ist. Es sind bis zu 300 Freiwillige beteiligt, die genau überwacht werden.
– Die dritte Phase sind klinische Massenversuche, die mehrere Phasen umfassen und Tausende von Menschen einbeziehen können.
Erst nach der dritten Phase der klinischen Prüfung beginnt der Prozess der Registrierung des Medikaments, der seine Wirksamkeit und Sicherheit bestätigt. Dabei ist es unwahrscheinlich, dass das Medikament zugelassen wird, wenn im Verlauf der klinischen Studien irgendwelche unerwünschten Daten gewonnen wurden.
Die Delegation des koreanischen Unternehmens überreichte damals dem Belarussischen Gesundheitsministerium ein Zertifikat über ein pharmazeutisches Produkt, das von dem koreanischen Ministerium für Lebensmittel- und Arzneimittelsicherheit ausgestellt wurde. Wie das Gesundheitsministerium mitteilt, bestätigt dieses Zertifikat mit der Nummer 5115 vom 27. Mai 2014, dass der Impfstoff “Eupenta” alle notwendigen Tests bestanden hat und somit sicher und wirksam ist. Auf der Website von PHARMA KOREA, die alle Informationen über im Land zugelassene und in der Entwicklung befindliche Medikamente enthält, heißt es jedoch: “Eupenta” ist nicht einmal im Herstellerland selbst zugelassen. Der Impfstoff befindet sich noch in der Forschungs- und Entwicklungsabteilung, gerade im Zulassungsprozess. Außerdem wurde er 2014 im “Iksan Plant” produziert und 2016 wurde die Produktion auf den neuen Standort Osong Campus verlegt, was automatisch alle zuvor erteilten Zulassungen annulliert, da die Produktionsstätte nicht inspiziert wurde. Welches Zertifikat die koreanische Firma dem Gesundheitsministerium also vorgelegt hat, ist nicht bekannt.
Kommentar des Gesundheitsministeriums – was ist wahr, was ist gelogen
 Es stellte sich heraus, dass in den Jahren 2015 und 2017 in mehreren Ländern auf der ganzen Welt Versuche mit “Eupenta” durchgeführt wurden. Das Medikament wurde jedoch in keinem der Länder zugelassen. Hinzu wurde in all diesen Ländern die Studien ausschließlich an Freiwilligen durchgeführt, die Geld bekamen und unter ständiger ärztlicher Aufsicht standen. Und es gibt keine Informationen über eine klinische Studie in Belarus, während das Gesundheitsministerium von 50 Millionen erfolgreichen Injektionen des Impfstoffes spricht. Es ist jedoch nicht klar, warum die Zulassungsbescheinigung nicht erteilt wurde. Zumal die Internetforen und -webseiten auch voller Berichte von Müttern sind, die über sehr negative Reaktion des Kindes auf “Eupenta” berichten.
Es stellte sich heraus, dass in den Jahren 2015 und 2017 in mehreren Ländern auf der ganzen Welt Versuche mit “Eupenta” durchgeführt wurden. Das Medikament wurde jedoch in keinem der Länder zugelassen. Hinzu wurde in all diesen Ländern die Studien ausschließlich an Freiwilligen durchgeführt, die Geld bekamen und unter ständiger ärztlicher Aufsicht standen. Und es gibt keine Informationen über eine klinische Studie in Belarus, während das Gesundheitsministerium von 50 Millionen erfolgreichen Injektionen des Impfstoffes spricht. Es ist jedoch nicht klar, warum die Zulassungsbescheinigung nicht erteilt wurde. Zumal die Internetforen und -webseiten auch voller Berichte von Müttern sind, die über sehr negative Reaktion des Kindes auf “Eupenta” berichten.
In seiner Stellungnahme sagte das Gesundheitsministerium, dass ein nicht registriertes Medikament nur dann in das Land importiert werden kann, wenn es in den Ländern, die Mitglied der ICH sind, registriert ist. Allerdings ist das gar nicht die Aufgabe der ICH. Es gibt keine länderübergreifenden Vereinbarungen und Verpflichtungen innerhalb dieser Organisation, ebenso wenig wie es eine gegenseitige Anerkennung der Arzneimittelzulassung gibt und grundsätzlich geben kann. Das Ziel der Organisation ist nicht die gegenseitige Anerkennung von Zulassungen, sondern lediglich die Entwicklung gemeinsamer Ansätze zur Qualitätskontrolle von Arzneimitteln. Und im Gesetz „Über Arzneimittel“ steht kein Wort über die ICH, sowie über die Präqualifikation der WHO und die Tatsache, dass man damit Arzneimittel ohne Registrierung in Belarus importieren kann. Denn das Präqualifikationsprogramm der WHO soll die Zulassung von Arzneimitteln in Entwicklungsländern erleichtern, die über keine eigenen Strukturen zur Qualitätskontrolle von Arzneimitteln verfügen.
Nach Angaben des Gesundheitsministeriums wurde die Entscheidung für den Kauf von “Eupenta” getroffen, nachdem der Hersteller des AKDS-Impfstoffs aus der Russischen Föderation, der Belarus seit langem mit immunbiologischen Arzneimitteln beliefert, nicht in der Lage war, rechtzeitig Impfstoffe in angemessener Qualität zu liefern. Sie sagen, dass, „um eine Notsituation zu verhindern“, insbesondere die Manifestation von gefährlichen Infektionskrankheiten, von denen 80% tödlich sind, die Entscheidung getroffen wurde, den Impfstoff “Eupenta” zu kaufen.
Es stellte sich heraus, dass Belarus wirklich eine schwierige Situation mit der Lieferung von Impfstoffen und der Umsetzung des nationalen Impfkalenders hatte – die Mütter vieler Kinder beschwerten sich darüber. Das Gesundheitsministerium erklärte: Die russische Firma “Microgen” hat es versäumt, Dosen des DTP-Impfstoffs in angemessener Qualität nach Belarus zu liefern. “Microgen” hingegen erklärte: Es habe keine Beanstandungen an der Qualität von DTP -impfstoffs gegeben, die Registrierung des Impfstoffs in Belarus laufe im Mai 2020 aus.
Informationen über den Kauf des Impfstoffs “Eupenta” durch UNICEF finden Sie auf der Website des Gesundheitsministeriums von Belarus. Auf der Website von The Korea Herald findet sich die Information, dass die Firma, die den Impfstoff herstellt, 2016 die Hoffnung äußerte den Impfstoff an UN-Organisationen, insbesondere UNICEF, zu liefern. Am 20. Oktober 2016 berichtete die Website von Business Korea, dass LG Chem einen Vertrag für die Lieferung von “Eupenta” an UNICEF von 2017 bis 2019 abgeschlossen hat. Etwa 30 Millionen Säuglinge sollten damit geimpft werden. Die Hersteller stellten klar, dass der Impfstoff die entsprechenden Zulassungstandards der Weltgesundheitsorganisation im Februar 2016 bestanden hat.
Wie ist “Eupenta” auf den Belarussischen Markt gekommen?
Sergei Satsuk analysierte die Beschaffung des Impfstoffs: Im Dezember 2016 gab es eine Auktion für den Kauf von Impfstoffen, die im Auftrag des ersten stellvertretenden Gesundheitsministers Dmitry Pinevich durchgeführt wurde. Unter anderem stand auch der DTP -Impfstoff auf der Liste. Aber hier ist die Überraschung: Das Volumen für den Impfstoff, der nur für 18 Monate gelagert werden kann, wurde mit mehr als einer halben Million Dosen angegeben! Zur gleichen Zeit war die Geburtenrate in Belarus für 2017 bei knapp 111 Tausend Kinder – was man, nebenbei bemerkt, ziemlich genau im Voraus berechnen kann. Bei der Ankündigung der Auktion für die Beschaffung von Impfstoffen hat „Belpharmazea” genau die Mengen festgelegt, die das Gesundheitsministerium ihr vorschrieb.
Daher konnte “Microgen” nicht die gesamte Menge des Impfstoffs liefern. Nach zwei gescheiterten Ausschreibungen wurde der Prozess zu einem Single-Source-Beschaffungsverfahren, bei dem das nicht registrierte “Eupenta” gekauft wurde. Und, natürlich, das Volumen betrug nicht eine halbe Million Dosen, sondern 2,5-mal weniger – 200 Tausend Dosen. Währenddessen wurden andere Impfstoffe, z.B. das französische “Pentaxime” von bekanntermaßen guter Qualität, ignoriert.
Ursprünglich wurde die Beschaffung von Impfstoffen auf Wettbewerbsbasis durchgeführt. In den Bedingungen hieß es, dass der Teilnehmer im Falle der Einreichung eines nicht registrierten Arzneimittels eine Garantieerklärung „zur Durchführung der staatlichen Registrierung von Arzneimitteln auf dem Territorium der Republik Belarus (unter Beifügung des Vertrags mit der UE „CEIZ“)“ vorlegen musste, d.h. nach dem Erhalt der Zulassung in Belarus. Aber es gab nie eine Zulassung von “Eupena”.
Früher wurde die Registrierung von Medikamenten verweigert, bei denen ein einziges Komma im Dokument fehlte, worüber sich auch viele Hersteller beschwerten. Auch wenn das Medikament zugelassen war und seit vielen Jahren nach Belarus geliefert wurde, konnte eine fehlerhaft gestaltete Anleitung ein Grund sein, das Medikament aus dem Verkehr zu ziehen. Aber die Gebrauchsanweisung von “Eupenta” ist überhäuft mit Mängeln: statt ein bestimmtes Verfallsdatum anzugeben, steht dort „ist nicht abgelaufen“, in der Spalte „Herstellungsart“ steht ein Hersteller und in der Spalte „Hersteller“ sind Rohstoffquellen und Ausstellungsdatum unklar, in der Spalte „Nebenwirkungen“ gibt es keine Beschreibung der Nebenwirkungen dieses Medikaments. Es ist unsinnig, dass Belarus ein Arzneimittel mit solchen Hinweisen und sogar ohne Beschreibung der Nebenwirkungen auf den Markt bringt. Ein solches Medikament gilt nach der belarussischen Gesetzgebung als minderwertig und unterliegt eigentlich einem Vertriebsverbot.
Reaktion des Gesundheitsministeriums auf Vorwürfe
Vertreter des Gesundheitsministeriums versuchten die Situation mit dem Kauf und der Verwendung des nicht registrierten Impfstoffs “Eupenta” zu erklären, aber das wirkte wenig überzeugend. Ihnen zufolge wurde fast jedes Jahr ein Problem mit der Qualität der Impfstoffe festgestellt. Bestimmte Serien von DTP -Impfstoffen waren in unserem Land nicht zur medizinischen Verwendung zugelassen. Um eine verlässliche Versorgungsgarantie zu gewährleisten, hat das Gesundheitsministerium im November die führenden Hersteller von registrierten Impfstoffen, zu denen auch Komponenten von Keuchhusten, Diphtherie und Tetanus gehören, gebeten, einen Weg zu finden, die benötigten Impfstoffe zeitnah zu liefern. Parallel dazu prüfte das Gesundheitsministerium die Möglichkeit von Einzellieferungen von DTP -Impfstoff aus anderen Ländern. Dies waren die Länder China, Indien und Korea. Im November 2017 wurde beschlossen, den “Eupenta”-Impfstoff aus einer einzigen Quelle zu beziehen.
Sergei Marchenko, stellvertretender Direktor des Zentrums für Expertise und Tests im Gesundheitswesen, fügte hinzu, dass der Import und die Verwendung des nicht registrierten “Eupenta”-Impfstoffs in Übereinstimmung mit dem Gesetz „Über Arzneimittel“, insbesondere Artikel 23, erfolgte. Die Fragen bleiben: Warum wurde die Registrierung des DTP -Impfstoffs nicht aufgehoben? Warum konnten sich die führenden Impfstoffhersteller nicht an der Ausschreibung zur Impfstoffbeschaffung beteiligen? Es gibt da eigentlich nur eine Antwortmöglichkeit. Die knapp 574.000 Dosen waren schwer in so kurzer Zeit zu liefern. Die Kosten pro Dosis betragen 40 Kopeken. Daher entschied sich das Gesundheitsministerium den nicht registrierten Impfstoff “Eupenta” aus einer Quelle zu beziehen. Das Ministerium betonte, dass der Impfstoff “Eupenta” importiert und zur Verwendung zugelassen wurde, „um Notsituationen von Ausbrüchen gefährlicher Infektionskrankheiten zu verhindern.“ Nicht registrierte Medikamente können dabei auch nach dem Gesetz importiert werden um die Folgen einer Notfallsituation vorzubeugen
Um einen LKW mit den Medikamenten auf das Territorium von Belarus bringen zu können, musste der Lieferant dem Zoll eine offizielle Registrierung in der Republik Belarus oder ein anderes Dokument des Gesundheitsministeriums vorlegen, auf dessen Grundlage die Lieferung erfolgte. Und hier haben wir eine weitere Frage: Was wurde in diesem Dokument geschrieben? Es ist unwahrscheinlich, dass das Gesundheitsministerium in dem Dokument angegeben, „um eine Notsituation der Ausbrüche von gefährlichen Infektionskrankheiten zu verhindern“. Die Zollbeamten kennen das Gesetz sehr gut, sie sind ständig mit der Lieferung von Medikamenten konfrontiert und es ist schwer zu glauben, dass sie eine solche Formulierung „abgekauft“ hätten, das sie nicht dem Gesetz entspricht.
Aussage des koreanischen Unternehmens: Wahrheit und Lüge
Das Gesundheitsministerium erhielt bald darauf eine Stellungnahme der Herstellerfirma des Impfstoffs. Es stellte sich heraus, dass die offizielle Website des Ministeriums für Lebensmittel- und Arzneimittelsicherheit (https://ezdrug.mfds.go.kr, auch bekannt als KFDA) korrekte und aktuelle Informationen hatte, dass der “Eupenta”-Impfstoff in Korea registriert war. Das Unternehmen hat auch eine Kopie des Zertifikats für pharmazeutische Produkte von “Eupenta” aus dem Jahr 2015 geschickt. (alte Version) und 2018. (aktualisierte Version). Welches Zertifikat aus dem Jahr 2014 von den Koreanern bei dem Besuch gezeigt wurde, ist weiter unklar. Das Gesundheitsministerium weigerte sich dies zu erklären und verwies auf die Tatsache, dass „im Zertifikat oder in der Anlage dazu immer eine Rezeptur (vollständige Zusammensetzung) des Fertigprodukts zu finden ist – diese Information offenbart im Detail die quantitative Zusammensetzung der Inhaltsstoffe im Produkt. Diese Information ist vertraulich“.
Sergei Satsuk merkt an, dass Zertifikate, die die Qualität und Sicherheit des Produktes bestätigen, öffentliche Dokumente sind, die keine geheimen Informationen enthalten und auch nicht enthalten dürfen. Und jedes Kontroll- und Analyselabor kann die quantitative Zusammensetzung jedes Medikaments leicht herausfinden. Dem Journalisten gelang es auch, die offizielle Website des Ministeriums für Lebensmittel- und Arzneimittelsicherheit zu finden – sie befindet sich unter einer anderen Adresse. Demnach war der Eupenta-Impfstoff im Jahr 2016 in Korea nicht registriert, und es gibt keinerlei Informationen über die Herstellerfirma.
Die von den Koreanern aufgelistete Website hingegen bietet Informationen, die nur für Einwohner Südkoreas verfügbar sind. In der offenen Form der Abfrage konnten wir nichts mit dem Wort „Eupenta“ finden, aber wir konnten das Zertifikat aus dem Jahr 2014 finden, von dem das Unternehmen sprach. In der Spalte „Registrierung/Lizenz“ in den Impfstoff-Registrierungsinformationen stand das Wort „Lizenz“, und zwar für den Export. Folglich ging die Aufsichtsbehörde davon aus, dass die Registrierung in dem Land erfolgen würde, in das das Medikament exportiert werden sollte.
Die Koreaner fügten ihrem Schreiben eine Liste von Ländern bei, in denen “Eupenta” registriert ist. Es handelt sich um Südkorea, Usbekistan, Pakistan, Sri Lanka, die Republik der Union von Myanmar, Syrien, Äthiopien, die Philippinen und die Demokratische Republik Kongo. Von diesen steht außer Südkorea keines auf der hochregulierten Liste, aber fast alle sind Teil des klassische WHO-Kontingent, bei dem Medikamente im Rahmen von Präqualifikations- und UN-Programmen geliefert werden. Die Medikamentenzulassung in diesen Ländern läuft folgendermaßen ab: Wenn es eine entsprechende Zulassungsbehörde gibt, registriert diese das Medikament auf Basis der WHO-Präqualifikation, ohne Dokumente, nur auf Basis des Vertrauens in die Organisation.
Auf den Websites der Gesundheitsministerien in Usbekistan und auf den Philippinen konnte übrigens kein Hinweis auf “Eupenta” gefunden werden.
Der Untersuchungsausschuss wurde in den Fall involviert.
 Als klar wurde, dass das Zertifikat Nr. 5115 kein Sicherheitsnachweis für den Impfstoff “Eupenta” sein kann, wurden der Untersuchungsausschuss und die Behörden in den Fall eingeschaltet. Sie veröffentlichten sofort eine weitere Mitteilung, in der das erste Zertifikat nicht erwähnt wurde (vielleicht, um zu verhindern, dass der Untersuchungsausschuss es zur Überprüfung beschlagnahmt), aber zwei neue Zertifikate erschienen. Dabei haben die Beamten des Gesundheitsministeriums die Koreaner nicht einmal gefragt, warum sie das Zertifikat plötzlich ausgetauscht haben und wie sie sich die Bereitstellung des ersten Zertifikats erklären können.
Als klar wurde, dass das Zertifikat Nr. 5115 kein Sicherheitsnachweis für den Impfstoff “Eupenta” sein kann, wurden der Untersuchungsausschuss und die Behörden in den Fall eingeschaltet. Sie veröffentlichten sofort eine weitere Mitteilung, in der das erste Zertifikat nicht erwähnt wurde (vielleicht, um zu verhindern, dass der Untersuchungsausschuss es zur Überprüfung beschlagnahmt), aber zwei neue Zertifikate erschienen. Dabei haben die Beamten des Gesundheitsministeriums die Koreaner nicht einmal gefragt, warum sie das Zertifikat plötzlich ausgetauscht haben und wie sie sich die Bereitstellung des ersten Zertifikats erklären können.
In der offiziellen Stellungnahme des Gesundheitsministeriums wies LG Chem auch darauf hin, dass der “Eupenta”-Impfstoff ursprünglich in der Produktionsstätte in Osong hergestellt wurde und dass die Präqualifikation durch die WHO nur nach drei Phasen klinischer Studien und nicht auf anderem Wege erteilt wird. Auf der Website der WHO heißt es dagegen, dass es nur eine Phase gab – die Ergebnisse von klinischen Studien, die an gesunden Freiwilligen durchgeführt wurden.
Im Jahr 2019 gab das Untersuchungskomitee die Ergebnisse einer Inspektion bekannt, die im Zusammenhang mit dem Tod des Kindes in Gantsevichi durchgeführt wurde, und erklärte, dass der “Eupenta”-Impfstoff von hoher Qualität war. Und fügte hinzu, dass „während der Inspektion Verstöße gegen das Beschaffungsverfahren festgestellt wurden, die mit einer unvollkommenen Gesetzgebung zusammenhängen und von der objektiven Notwendigkeit diktiert wurden, eine große Menge an Impfstoff in der kürzest möglichen Zeit zu kaufen.“
Laut Untersuchungsschuss, haben die Ermittler die Dokumentation studiert, die die Qualität des “Eupenta”-Impfstoffs bestätigt: darunter die Zertifikate der Fabrikanalyse des Medikaments aus Südkorea und das für das Importland ausgestellte Zertifikat. Gleichzeitig hat sich der Untersuchungskomitee nicht dazu geäußert, wie die Notwendigkeit des einmaligen Kaufs einer großen Anzahl von Impfstoffen entstanden ist, warum die kritische Situation mit dem Impfstoff künstlich geschaffen wurde, um den nicht registrierten “Eupenta” auf den Markt zu bringen. Es wurde nicht auf die fehlende Bestätigung der Wirksamkeit und Sicherheit des Impfstoffs eingeganen und keine rechtliche Bewertung der Handlungen der Beamten des Gesundheitsministeriums vorgenommen, die den Impfstoff ohne Bestätigung seiner Wirksamkeit und Sicherheit nach Belarus zugelassen haben. Am überraschendsten ist jedoch die Tatsache, dass der Untersuchungskomittee überhaupt nichts über die Präqualifikation des “Eupenta”-Impfstoffs durch die Weltgesundheitsorganisation sagte.
„Derzeit wird die Immunisierung mit dem “Eupenta”-Impfstoff in Belarus fortgesetzt. Außerdem wurden von Januar bis August 2018 etwa 100.000 Impfungen mit “Eupenta” durchgeführt und nur in zwei Fällen wurden Nebenwirkungen registriert. Die Zahl solcher Reaktionen nach Verabreichung eines zuvor verwendeten anderen Impfstoffs war im Durchschnitt um ein Vielfaches höher“, fasste der Untersuchungsausschuss seine Inspektion zusammen. Die Position des Untersuchungsausschusses, dass es keinen Zusammenhang zwischen den Verstößen im Beschaffungsverfahren und dem Tod des Kindes gibt, ist recht überraschend, da die Nebenwirkungen des Medikaments nicht berücksichtigt wurden.
Registrierung von “Eupenta” in Belarus
Im Mai 2019 wurde berichtet, dass das staatliche Arzneimittelregister des Zentrums für Expertise und Prüfung im Gesundheitswesen angibt, dass der Impfstoff am 1. März nun doch zugelassen wurde. Die Zulassung läuft bis zum 1. März 2024. Weder das Gesundheitsministerium noch der Untersuchungskomitee haben sich zu den Gründen geäußert, warum der Impfstoff importiert und in Belarus zugelassen wurde. Hinzu durfte es ja laut Gesetz nur für klinische Versuche importiert werden.
Wer hat das Experiment an den belarussischen Kindern erlaubt?
Valery Malashko war im Jahr des Vorfalls im Bezirk Gantsevichy der Gesundheitsminister. Er trat sein Amt im Januar 2017 an – zu diesem Zeitpunkt begannen die ersten Impfungen mit dem “Eupenta”-Impfstoff in Belarus. Davor arbeitete er als stellvertretender Vorsitzender des regionalen Exekutivkomitees in Mogilev. Seine Ernennung zum Leiter des Gesundheitsministeriums war recht merkwürdig: Im Dezember 2016 wurde Malashko zum Minister für Arbeit und Sozialschutz ernannt. Eineinhalb Monate später änderte Alexander Lukaschenka seine Meinung und schickte ihn an die Spitze des Gesundheitsministeriums.
Valery Malashko war etwas mehr als zwei Jahre im Amt und ist für einige abscheuliche Entscheidungen in Erinnerung geblieben. Das erste ist das Projekt des Verkaufs von Kontaktlinsen auf Rezept. Die Innovation wurde im Sommer 2017 im Gesundheitsministerium aktiv diskutiert. Die Regierung schlug vor die Möglichkeit des Verkaufs von Linsen und Brillen auf Rezept zur Diskussion zu stellen und den Verkauf von Linsen in speziellen Verkaufsautomaten zu verbieten. Vertreter des Gesundheitsministeriums sprachen über die Schädlichkeit von Linsen. Dieses Projekt wurde jedoch nie umgesetzt – das Gesundheitsministerium weigerte sich dann letzendlich, sich damit zu befassen.
Ebenfalls mit Valery Malashko startete das Gesundheitsministerium das Projekt der Digitalisierung von Krankenkarten und elektronischen Rezepten. Es wurde angenommen, dass alle Patienten medizinische Aufzeichnungen mit Informationen über ihre Gesundheit für das gesamte Leben haben würden und alle medizinischen Einrichtungen würden Zugang zu solchen medizinischen Aufzeichnungen haben. Das hatte zur Folge, dass die Ärzte doppelte Arbeit leisten mussten: sowohl Papier- als auch elektronische Akten ausfüllen, Rezepte von Hand ausstellen und dann in einen Computer eingeben.
Kurz bevor er seinen Posten verließ, kündigte Malashko an, dass Allgemeinmediziner die spezialisierten Fachärzte in den Polikliniken ersetzen würden. Das Gesundheitsministerium ging davon aus, dass dies die Arbeitsbelastung der spezialisierten Fachärzte reduzieren würde. Während seiner Rede auf der Weltgesundheitsversammlung versprach Malaschko, die Arbeit der Polikliniken zu reformieren, die einen Kurs in Richtung umfassender, integrierter und patientenorientierter Gesundheitsdienstleistungen einschlagen werden. Allerdings hat dieser Ansatz überhaupt nicht das Problem der Warteschlangen bei Fachärzten in Polikliniken gelöst.
 Schließlich kam es unter Malaschko zum lautesten medizinischen Korruptionsskandal in der Geschichte Belarus. Am 25. Juni 2018 gab der KGB-Vorsitzende Valery Vakulchik eine Erklärung ab, dass das Komitee „ein groß angelegtes Korruptionsschema im Gesundheitssektor aufgedeckt hat.“ Im Januar 2019 betraf der „Fall der medizinischen Arbeiter“ 93 Personen: 30 Beamte des Gesundheitssystems und 63 Personen – Eigentümer (Gründer), Manager und Angestellte von kommerziellen Strukturen. Alle wurden verdächtigt Bestechungsgelder von bis zu mehreren zehntausend Dollar für die Lösung von Problemen in ihrem Zuständigkeitsbereich angenommen zu haben. Unter den Verhafteten befanden sich der stellvertretende Gesundheitsminister Igor Lositski, der Direktor des Russischen Wissenschafts- und Praxiszentrums für Traumatologie und Orthopädie Alexander Beletski, der Chefarzt des 1. Krankenhauses in Minsk Oleg Fomin, die Leiterin der Abteilung für Apothekeninspektion und Organisation der Arzneimittelversorgung der Stadt Minsk Ljudmila Reutskaja sowie mehrere Direktoren von medizinischen Unternehmen und Kliniken. Die Angeklagten wurden zu unterschiedlichen Strafen verurteilt, die von einer Geldstrafe bis zu sieben Jahren Gefängnis reichten. Valeri Malashko kommentierte den Ausgang des „medizinischen Falles“ und sagte, dass auch die Führung des Gesundheitsministeriums im Korruptionsskandal schuldig sei, aber „Korruption gibt es in jeder Gesellschaft und auf jeder Ebene“. Außerdem versprach Valery Malashko das Beschaffungssystem und das Einstellungssystem zu reformieren. Im September 2018 stellte Lukaschenko ihm während eines Treffens eine Frage: „Sagen Sie mir ehrlich, unter uns: Sind Sie in der Lage das Ministerium zu führen? Wenn Sie nicht fähig sind, wird es nur noch schlimmer werden.“
Schließlich kam es unter Malaschko zum lautesten medizinischen Korruptionsskandal in der Geschichte Belarus. Am 25. Juni 2018 gab der KGB-Vorsitzende Valery Vakulchik eine Erklärung ab, dass das Komitee „ein groß angelegtes Korruptionsschema im Gesundheitssektor aufgedeckt hat.“ Im Januar 2019 betraf der „Fall der medizinischen Arbeiter“ 93 Personen: 30 Beamte des Gesundheitssystems und 63 Personen – Eigentümer (Gründer), Manager und Angestellte von kommerziellen Strukturen. Alle wurden verdächtigt Bestechungsgelder von bis zu mehreren zehntausend Dollar für die Lösung von Problemen in ihrem Zuständigkeitsbereich angenommen zu haben. Unter den Verhafteten befanden sich der stellvertretende Gesundheitsminister Igor Lositski, der Direktor des Russischen Wissenschafts- und Praxiszentrums für Traumatologie und Orthopädie Alexander Beletski, der Chefarzt des 1. Krankenhauses in Minsk Oleg Fomin, die Leiterin der Abteilung für Apothekeninspektion und Organisation der Arzneimittelversorgung der Stadt Minsk Ljudmila Reutskaja sowie mehrere Direktoren von medizinischen Unternehmen und Kliniken. Die Angeklagten wurden zu unterschiedlichen Strafen verurteilt, die von einer Geldstrafe bis zu sieben Jahren Gefängnis reichten. Valeri Malashko kommentierte den Ausgang des „medizinischen Falles“ und sagte, dass auch die Führung des Gesundheitsministeriums im Korruptionsskandal schuldig sei, aber „Korruption gibt es in jeder Gesellschaft und auf jeder Ebene“. Außerdem versprach Valery Malashko das Beschaffungssystem und das Einstellungssystem zu reformieren. Im September 2018 stellte Lukaschenko ihm während eines Treffens eine Frage: „Sagen Sie mir ehrlich, unter uns: Sind Sie in der Lage das Ministerium zu führen? Wenn Sie nicht fähig sind, wird es nur noch schlimmer werden.“
Die Verfolgung von Sergei Satsuk
Im August 2019 (ein Jahr nach der Veröffentlichung des Impfstoffs) strahlte der staatliche Fernsehsender Belarus-1 einen Bericht aus, in dem Satsuk beschuldigt wurde „gekaufte Artikel“ zu schreiben. Ein gewisser Geschäftsmann Viktar Medvedski behauptete, er habe dem Journalisten 3.000 Dollar für die Vorbereitung eines weiteren Artikels über Korruption im Gesundheitsministerium gegeben.
Im März 2020 schrieb Sergey Satsuk eine Kolumne mit dem Untertitel „Wer sät Panik um das Coronavirus, der Präsident oder Websites und Kanäle?” Er äußerte Zweifel an der offiziellen Zahl der Kranken und kritisierte die Untätigkeit der Behörden in Bezug auf die Unterstützung von Unternehmen in schwierigen Zeiten.
Am 25. März 2020 nahmen Beamte der Finanzermittlungsabteilung des staatlichen Kontrollkomitees Sergey Satsuk fest. Der Grund für die Verhaftung war, dass Sergey Satsuk vor mehr als einem Jahr angeblich Geld für journalistische Recherchen erhalten hatte.
Zuvor sagte Satsuk, dass er wegen seiner Antikorruptionsuntersuchungen bedroht wurde. Die Journalisten von „Ezhednevnik“ nannten Satsuks Verhaftung „ein Fragment des Kampfes korrupter Beamter gegen den Mann, der es wagte in ihr aufgebautes System einzugreifen“. Der Belarussische Journalistenverband fordert die Behörden auf die Strafverfolgung von Satsuk einzustellen.
Am 4. April wurde die Untersuchungshaft gegen Sergey Satsuk aufgehoben. Der Generalstaatsanwalt von Belarus traf die entsprechende Entscheidung. Sergey Satsuk ist nie angeklagt worden. Allerding Leute, die ihr hart verdientes Geld gespendet haben, um Sergey Satsouks investigativen Journalismus zu unterstützen, wurden nun aber zur Vernehmung im Untersuchungskomittee vorgeladen.


